ÚJ IRÁNYZATOK A MŰSZER ÉS MÉRÉSTECHNIKÁBAN |
Napjainkban a tudományos kutatások során több területen is központi szerepet játszik a különböző műszerek, berendezések méretének csökkentése (miniatürizációja). Ez a folyamat néhány évtizeddel ezelőtt kezdődött az elektronikai iparban az integrált áramkörök kifejlesztésével. Ennek legkézzelfoghatóbb eredménye, a manapság már mindenki számára elérhető, személyi számítógép, amelynek mind az ára, mind a helyigénye rendkívüli módon lecsökkent az utóbbi néhány évtizedben.
Hasonló folyamatok játszódnak le az analitikai kémiában is: napjainkban az analitikai kémiai berendezések (ezen belül a cikk tárgyát képező elválasztástechnikai eszközök) méretcsökkenésének lehetünk tanúi. Habár a tudósokat már régóta foglalkoztatta a gondolat, az első lépéseket csak kb. egy évtizeddel ezelőtt, az 1990-es évek elején tették meg az analitikai kémiai műszerek területén. A tématerület úttörői Jed Harrison, Andreas Manz és J. Michael Ramsey voltak. Az analitikai mikrochipek készítésekor felhasználják a mikroelektronikai iparban alkalmazott mikromegmunkálási eljárásokat, a chipeket fotolitográfiás módszerekkel munkálják meg. A chipek készítése során a chip felületén különböző csatornákat alakítanak ki. Ezekben a csatornákban történik a minta és kémszer (kémszer) oldatok áramoltatása, összekeverése, a minta összetevőinek szétválasztása, végül az érzékelés. Az oldatok továbbítása és az elválasztás legtöbb esetben elektromos feszültség hatására történik.
A miniatürizáció során a végső cél az, hogy a teljes mérési eljárást (vagyis a minta beadagolását, a kémszerek hozzáadását, összekeverését, az esetleges kémiai reakció lejátszódását, a mintakomponensek szétválasztását, az érzékelést) a chipen valósítsák meg, mégpedig úgy, hogy a mérés közben ne történjen emberi beavatkozás, ezzel is csökkentve a hiba lehetőségét.
A készülékek méretcsökkentésére irányuló tudományos kutatások hajtóereje a miniatürizált berendezések által nyújtott előnyök kiaknázása. A miniatürizált eszközök alkalmasak arra, hogy a hagyományos berendezésekhez képest nagyobb mintaátviteli sebességet tegyenek lehetővé. Ezt egyfelől a chipek megfelelő kiépítésével lehet elérni, ami azt jelenti, hogy a chipen egymás mellett több analízis-csatornát helyeznek el, amelyekben a mintákat párhuzamosan mérik. Másik oldalról pedig egy adott minta méréséhez szükséges idő is lecsökken, ami szintén növeli az időegység alatt mért mintaszámot. Az ilyen nagysebességű mintaelemzésre van szükség pl. a gyógyszerkutatásban a kombinatórikus könyvtárak analízisénél, vagy a génkutatásban a DNS szekvenciák felderítése során.
Fontos megemlíteni, hogy a vizsgálatokhoz szükséges minta és kémszer-mennyiség is jóval kevesebb, mint a hagyományos berendezések esetében, így az elemzés költsége alacsonyabb lesz, emellett a mérések során keletkező hulladék mennyisége is jelentősen lecsökken, ami szintén költségmegtakarítást jelent, illetve környezetvédelmi szempontból is kedvezőbb. A miniatürizált berendezések könnyen mozgathatók, szállíthatók, így alkalmasak lehetnek a laboratóriumon kívüli mérések elvégzésére is. Viszonylag alacsony előállítási költségük lehetővé teszi, hogy egyszer használatos, eldobható chipeket készítsenek, kizárva ezzel az egymás utáni méréseknél a keresztszennyeződések lehetőségét.
A chipek működése szempontjából az egyik legfontosabb probléma a minta és kémszer oldatok csatornákban történő mozgatásának megoldása. Az egyik kézenfekvő megoldás a hagyományos készülékek (pl. kromatográfia) esetében alkalmazott módszer, amikor az áramlást pumpa segítségével - nyomásszabályozó szelepek alkalmazásával - idézik elő. Ennek az eljárásnak a mikroméretű megvalósítása azonban nehézségekbe ütközik, egyrészt mert, a pumpa chipen történő kialakítása nehezen megoldható, másrészt mert a megfelelő nyomásszabályozó szelepek gyártását még nem oldották meg.
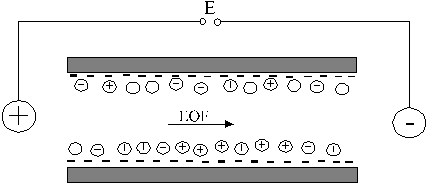
A fenti problémák miatt napjainkban a legelterjedtebben használt módszer a folyadékok áramoltatására a feszültségkülönbség hatására létrejövő áramlás, az ún. elektroozmotikus áramlás.
Az elektroozmotikus áramlás kialakulását szemlélteti az 1. ábra. A csatorna falát úgy képezik ki, hogy az valamilyen (általában negatív) elektromos töltésű csoportokat tartalmazzon. Ebben az esetben az oldatban lévő kationok a negatív töltésű falhoz vándorolnak, ezzel a csatorna felületén elektromos kettősréteget alakítanak ki. A csatorna két végére elektromos feszültséget kapcsolva a felületen lévő szolvatált kationok elmozdulnak a negatív töltésű elektród irányába, és ezzel mozgásba hozzák a csatornában levő oldatot.

Az elektroozmotikus áramlás a következő jellemzőktől függ:
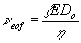
| ahol: |  : : |
elektroozmotikus áramlás sebessége |
| z: | "Zeta" potenciál, a kettősrétegen kialakuló potenciálkülönbség | |
| E: | az alkalmazott elektromos térerősség | |
| Do: | puffer dielektromos állandója | |
| h: | viszkozitás |
A 2. ábrán az elektroozmózis és a külső nyomás hatására kialakuló áramlási sebességeloszlás látható. Az "a" ábrán látható, hogy az elektroozmotikus áramlás esetében a sebességeloszlás az analíziscsatorna majdnem teljes keresztmetszetében állandó, csak a csatornafal közvetlen közelében csökken le. A "b" ábra a nyomás hatására kialakuló parabolikus áramlási sebességeloszlást mutatja be, melynél a sebesség az analíziscsatorna közepén jóval nagyobb, mint a falhoz közelebbi részeken. Az elektroozmotikus áramlás tulajdonságát a mintakomponensek elválasztásánál jól ki lehet használni. Ilyenkor ugyanis az elválasztás során a mintakomponensek zónakiszélesedése kisebb mértékű, mint külső nyomás alkalmazása esetén, ezáltal nagyobb hatékonyság érhető el az elválasztás során.
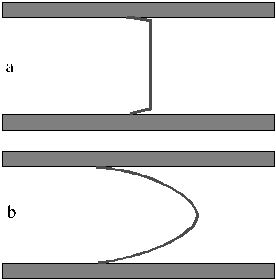
2. ábra. Sebességeloszlás a mikroméretű csatornákban elektroozmotikus áramlás (a) és külső nyomás alkalmazása esetén (b)
Az elektroozmózis alkalmazásának előnye, hogy az áramlás létrehozására nincs szükség mozgó alkatrészekre. Az áramlást előidéző feszültség alkalmazására használt elektródok viszonylag egyszerűen kialakíthatók a chipek felületén. Az elektroozmotikus áramlás sebessége egyszerűen változtatható az alkalmazott feszültség nagyságának változtatásával, sőt az áramlás iránya is egyszerűen megfordítható az elektródok polaritásának felcserélésével. Hátránya viszont, hogy az áramlás nagysága sok egyéb paramétertől (z potenciál, puffer pH, ionerősség, stb.) függ, ezért az áramlás megismételhetősége nem mindig kielégítő. Másik probléma, hogy a töltéssel rendelkező részecskék eltérő sebességgel vándorolnak az elektromos erőtér hatására (ugyanakkor ezt a hatást használjuk ki a mintaösszetevők elválasztásakor kapilláris elektroforézis esetén).
Az elektroozmotikus áramlás mellett más, különböző áramlási eljárások kifejlesztése is folyamatban van.
Van den Berg és munkatársai az elektroozmotikus áramlás szabályozására egy új eljárást dolgoztak ki. A mikroelektronikában alkalmazott FET tranzisztorok mintájára kifejlesztették az ún. "flowFET"-et. A flowFET három elektródot alkalmaz az áramlás szabályozására. Az áramlást a csatorna falán kialakuló kettősrétegre adott feszültség (vagyis a Zeta potenciál) változtatásával szabályozzák. Így viszonylag kis feszültség alkalmazásával összetett áramlási profilokat lehet kialakítani.
Másik lehetőség az áramlás szabályozására a csatorna falának bevonása különböző polielektrolit rétegekkel. Az analíziscsatorna falán kialakuló töltést a polielektrolit réteg megváltoztatja, így az áramlás sebessége is változik. Alkalmas felviteli eljárással, hogy a megvalósítható csatorna két oldalfalára más típusú, ellenkező töltésű polielektrolit réteg kerüljön fel, így elérhető, hogy egy analíziscsatornán belül két egymással ellentétes irányú áramlás lépjen fel.
Ichimura és munkatársai a folyadékcseppek mozgatását felületi szabadenergia gradiens kialakításával érték el. A felületen kalixarén származékot rögzítettek, amelyhez transz-azobenzol molekulákat kötöttek. Az azobenzol molekulák helyi UV besugárzás hatására izomerizálódnak cisz-azobenzollá, és az így kialakuló felületi szabadenergia változás hatására a folyadékcsepp elmozdul a cisz azobenzol molekulák irányába. A csepp mozgásának irányát így a besugárzó UV fényforrás helyzetének megválasztásával lehet változtatni. A felület később regenerálható a cisz azobenzol molekulák transz-azobenzollá történő átizomerizálásával.
Laibinis és munkatársai felületi adszorpciós jelenségeket használtak fel folyadékcseppek mozgatására. Karboxil-csoportokat tartalmazó felületi rétegen mozgattak egyenes szénláncú primer amint tartalmazó dekahidronaftalin cseppeket, úgy hogy a mozgás során a csepp maga mögött hagyta a felületre adszorbeálódó amin réteget. Az amin szénlánc hosszának változtatásával a csepp vándorlás sebessége szabályozható.
Más kísérletekben hőmérsékletlépcsőket alkalmaznak a folyadékcseppek mozgatására megfelelően kialakított csatornákban. Nyíróerő hatására létrejövő folyadékszállításról is lehet olvasni az irodalomban, ebben az esetben előnyt jelent a nagy sebességek alkalmazásának lehetősége.
A chipeket általában egy néhány centiméter élhosszúságú téglalap alakú lapon alakítják ki úgy, hogy megfelelő mikromegmunkálási eljárással felületi mikrostruktúrákat (csatornákat, fém csatlakozásokat, stb.) hoznak létre. A mikrostruktúrák mérete néhány mikrométertől néhány száz mikrométerig terjed. A chipek többféle alapanyagból készíthetők. A legáltalánosabban alkalmazott anyag az üveg és a kvarc. Ezek felületének megmunkálására jól alkalmazhatók a mikroelektronikában használt fotolitográfiás eljárások.. Emellett jó fénytani tulajdonságai miatt összeegyeztethető a különböző érzékelési módszerekkel. Az üveg felületén levő szilanol csoportok könnyen ionizálhatók, ezért alkalmas elektroozmotikus áramlás létrehozására. Van azonban hátrányos tulajdonsága is az üveg alapú chipeknek, mégpedig az, hogy viszonylag magas az előállítási költségük. Emiatt az utóbbi néhány évben többen is megpróbáltak különböző polimereket alkalmazni a chipek kialakítására. A polimer chipek használatának előnye, hogy előállításuk gyorsabb és olcsóbb, mint az üvegből készülteké, ezért akár egyszer használatos, egy mérésre gyártott chipek alkalmazása is lehetséges.
A chipek készítéséhez többfajta polimer használható (poli-dimetil-sziloxán (PDMS), poli-metil-metakrilát (PMMA), poli-etilén-tereftalát, poli-tetrafluor-etilén, polisztirol, cellulóz-acetát, stb.). Az alkalmazott polimerekkel szemben támasztott követelmények: legyen megmunkálható, jó fénytani tulajdonságokkal rendelkezzen (optikailag legyen "átlátszó", ne adjon háttérfluoreszcenciát), a mérés körülményei között legyen semleges (ne oldódjon/duzzadjon szerves oldószerben), felületét lehessen módosítani. Ez utóbbira azért lehet szükség, mert a polimerek egy része csak kis elektroozmotikus áramlási sebességet képes létrehozni, így az áramlási sebesség növelése érdekében a csatornafalak kémiai módosítására van szükség.
A chip felületén kialakított csatornák elhelyezkedése is változott az évek során. A legegyszerűbb chipek mintabeadagoló csatornát, analíziscsatornát (amelyekben általában elektroforetikus elválasztást végeznek), ezek végein minta és puffertartályokat tartalmaznak. Az analíziscsatornában szétválasztott minta-alkotók mérésére szolgáló érzékelőket is gyakran a chip felületén alakítják ki.
Az első chipeken az analíziscsatornák egyenesek voltak, ahogy az a 3.a. ábrán látható. Ezek a csatornák azonban sok esetben nem biztosítottak elég nagy elválasztási hatékonyságot. A felbontás növelését azonban csak a csatornahossz növelésével lehet elérni. A kisméretű chipeken azonban csak úgy lehet megnövelni az elválasztási csatorna hosszát, ha kanyarokat is kialakítunk benne (3.b ábra). Így az analíziscsatorna hossza akár többszöröse is lehet a mikrochip élhosszúságánál. Az ilyen kanyarokat tartalmazó chipeken történő mérések során azonban azt tapasztalták, hogy az elválasztás hatékonysága nem nő az analíziscsatorna hosszúságával arányosan, ami annak köszönhető, hogy a beépített kanyarokban nagymértékű zónakiszélesedés következik be. Ez könnyen belátható, hiszen a kanyar belső ívén utazó molekulák sokkal rövidebb utat tesznek meg, mint a külső íven vándorlók. A belső íven utazó molekulák előbbre jutnak, a külső íven utazók pedig lemaradnak. Ehhez még hozzájárul, hogy a rövidebb úton nagyobb a térerősség, tehát nagyobb sebességgel mozognak a molekulák.
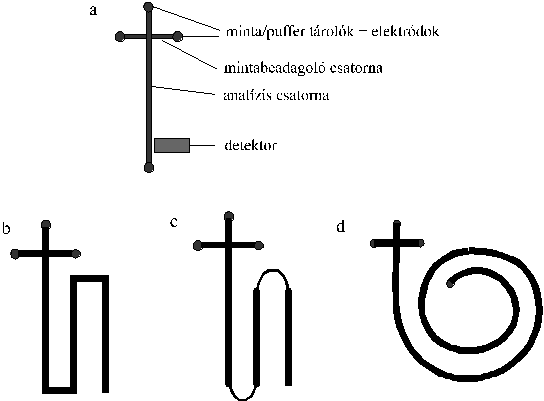
3. ábra. A chip vázlatos felépítése és a különböző típusú analíziscsatornák
Ezeket a hatásokat csökkenteni lehet, ha a csatornák kialakításánál nem a hagyományos 90 és 180 fokos fordulatokat alkalmazzák, hanem minél nagyobb ívű hajlatokat alakítanak ki a felületen (3.c. ábra). Másik hatásos eszköz, amikor a hajlatokban lecsökkentik az analíziscsatorna átmérőjét. Hasonlóan jó megoldás, amikor az analíziscsatornát spirális alakban alakítják ki a chip felületén (3.d. ábra).
Az elemzés egyik fontos lépése a minta bejuttatása az analíziscsatornába. A mintabeadagolási (injektálási) technikának megbízhatónak, megismételhetőnek kell lennie. A külső nyomás hatására történő mintabeadagolás nem terjedt el, mert a nyomásszabályozó egységek a kialakítása chipek felületén nehézségekbe ütközik. A legelterjedtebb mintaadagolási módszer az elektromos feszültség hatására történő ún. elektrokinetikus adagolás.
Ennek a legegyszerűbb változata, amikor adott ideig megfelelő feszültséget alkalmazva az adagoló ágból az analíziscsatornába juttatjuk a mintát (4.a. ábra). Ilyenkor azonban (akárcsak a hagyományos kapilláris elektroforézisben) a feszültség hatására gyorsabban mozgó mintaösszetevőkből több kerül be az analíziscsatornába. Ennek a kiküszöbölésére kifejlesztettek egy új típusú adagolót, ahol a bejuttatott mintamennyiséget a mintaág és az analíziscsatorna közös szakasza határozza meg. Az ilyen adagolót nevezik T, vagy kettős T adagolónak (4.b,c ábra). A mintabejuttatásnál először a mintaágra adott feszültséggel feltöltik a mintaoldattal a közös szakaszt (4.b. ábra), majd az analíziscsatornára kapcsolt feszültség hatására megkezdődik az elválasztás. Ennek a módszernek a hátránya, hogy az adagolás után is bekerülhet a minta a rendszerbe, ami nagy háttérzajt okozhat. Ez megszüntethető, ha közvetlenül az adagolás után ellentétes irányú feszültséget adunk a mintaágra, ami megakadályozza mintakösszetevők analíziscsatornába jutását (4.c. ábra).
Az ún. kapuzott adagolás során a mintaoldat folyamatosan áramlik a mintatartályból az adagolási zónán keresztül. Ugyanakkor az analíziscsatornában is folyamatosan áramlik a pufferoldat (4.d. ábra). Adagolás akkor történik, amikor a feszültség kikapcsolásával rövid időre felfüggesztik az analíziscsatornában levő puffer áramlását (4.e és f. ábrák). Ennél az eljárásnál az adagolási idő változtatásával különböző térfogatú mintarészletek bejuttatása válik lehetővé.
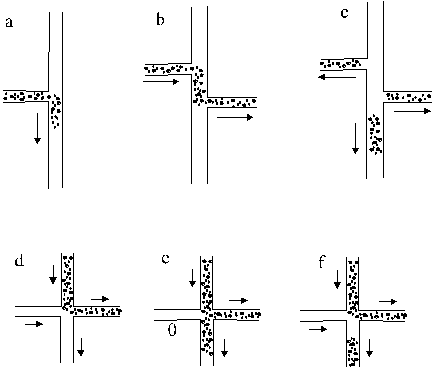
4. ábra.Elektrokinetikus mintaadagolási technikák
Az a, b és c ábrákon az analíziscsatorna függőleges, a mintabeadagoló csatorna vízszintes. A d, e és f ábrákon a bal oldali és az alsó az analíziscsatorna, míg a felső és a jobb oldali az adagoló csatorna. A nyilak az áramlási irányt jelölik.
A mikro méretű csatornákban történő elemzés során az áramlás jellemzője különbözik a hagyományos méretű berendezéseknél tapasztalt áramlástól. A folyadékáramlás lamináris és turbulens lehet. A kettő között a Reynolds szám ismeretében tehetünk különbséget. A Reynolds számot a következőképpen lehet kiszámítani:
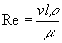 ,
,
ahol v az áramlás sebessége, l a csatorna átmérője, r folyadék sűrűsége, m pedig a viszkozitása.
Ha a Reynolds szám értéke kb. 2000 alatt van, lamináris, ha efelett, akkor turbulens áramlásról beszélünk. A csatornák kis átmérője miatt a mikrochipek esetében legtöbbször lamináris az áramlás, ellentétben a hagyományos berendezésekkel, ahol turbulens áramlásról beszélhetünk. Lamináris áramlás esetén a kapillárisban két vagy több egymásra rétegezett folyadék áramlása során a folyadékok határfelületén nem lép fel turbulencia, a folyadékok keveredése csak diffúzió útján történhet. A lamináris áramlás előnyeinek kihasználásával új típusú eljárások alkalmazása válik lehetővé.
Fentiek alapján a felületek megmunkálását lehet elvégezni két, laminárisan áramló oldat határfelületén. A két oldat komponensei a határfelületen kölcsönhatásra lépve olyan terméket hoznak létre, amely a megfelelő csatorna kimaratását eredményezi. Ilyen pl. a sósav és a kálium-fluorid oldat, amelyek határfelületén hidrogén-fluorid keletkezik, ami a szilícium-oxid szubsztrát kimarásával alakítja ki a mikroméretű csatornát.
Fémek felületre történő kiválasztása is megvalósítható a módszerrel, pl. ezüst-halogenid oldat és megfelelő redukálószer határfelületén ezüst válik ki.
A folyadékok közötti határfelületi diffúzió kihasználásával eltérő nagyságú molekulák szétválasztása is elvégezhető.
Az analitikai mikrochipeket legelterjedtebben a biológiai minták, ezen belül is a DNS elemzésére alkalmazzák. Olyan berendezéseket készítenek, amelyek a DNS elemzést emberi beavatkozás nélkül végzik el a beadagolástól kezdve egészen a érzékelésig. Mivel a DNS minta gyakran annyira alacsony koncentrációjú, hogy nem lehet érzékelni, ezért a chipekre beépítenek még egy enzim által létrehozott DNS sokszorosítási lépést (polymerase chain reaction PCR) is. A minta elválasztása elektroforézissel történik, az érzékelés során a minta által kibocsátott fluoreszcenciás fényt mérik. A nagyobb mintaátbocsátási sebesség érdekében kifejlesztettek olyan chipeket, amelyeken egymás mellett több párhuzamos csatornában folyik a DNS elemzés. Egy chipen akár 96 csatorna is kialakítható.
Annak ellenére, hogy a tudományág viszonylag rövid múltra tekint vissza, már a kereskedelemben is lehet kapni mikrochipen alapuló elválasztástechnikai eszközöket. Az egyik gyártó cég a Caliper Technologies, amely általános célú, mikrochipen kialakított kapilláris elektroforézises berendezést árul.
A Sandia National Laboratories egy hordozható analizátort fejlesztett ki, amit mChemLab-nak neveztek el. A készüléket a vegyi fegyverek által kibocsátott anyagok meghatározására fejlesztették ki. Egy kapilláris elektroforézises és egy gázkromatográfiás egységet helyeztek el a készülékben. A mérési idő kevesebb, mint egy perc, az érzékelési határ a ppb tartományban van.
A mikrochipeken kialakított, elválasztástechnikán alapuló analitikai berendezések egyre inkább az érdeklődés középpontjába kerülnek. Jelzi ezt az is, hogy évről évre egyre több tudományos közlemény jelenik meg ebben a témában.
Annak ellenére, hogy már a kereskedelemben is kaphatók analitikai mikrochipek, az eljárás még a fejlesztés állapotában van. Újabb anyagokat és megmunkálási eljárásokat alkalmaznak a chipek előállítási árának csökkentése érdekében, tovább fejlesztik az áramoltatási eljárásokat a jobb megismételhetőség érdekében, újabb és újabb érzékelési módszereket dolgoznak ki. Összességében elmondható, hogy a technika továbbfejlődése során egyre nagyobb szerepet játszik a kémiai, biológiai elemzés területén.
| KAPUI IMRE* |
|
| *: | EGIS Gyógyszergyár Rt. |
A laprendszer készítője: UFE